La entropía: concepto y relación con la física y la química
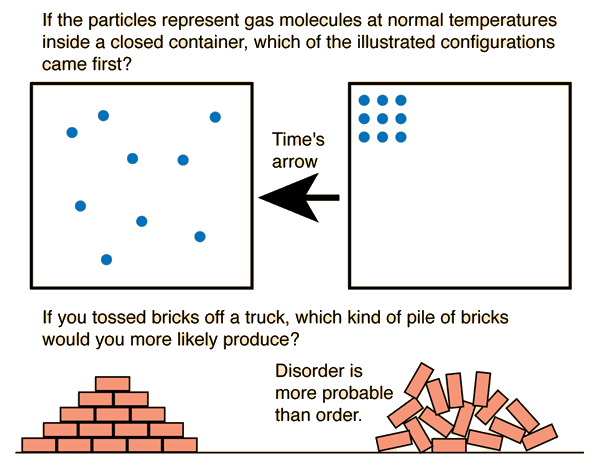
La entropía es un concepto fundamental en varias disciplinas científicas, como la física y la química. Su significado y aplicación varían según el campo en el que se utilice, pero en general, la entropía se relaciona con la probabilidad, el desorden y la transformación de la energía en un sistema.
En este artículo, exploraremos en detalle el concepto de entropía y su relación con la física y la química. Analizaremos su importancia en la termodinámica y su papel en el segundo principio de la misma. Además, discutiremos cómo se calcula y se expresan las unidades de la entropía en sistemas físicos y químicos. También examinaremos la relación entre la entropía y la energía no aprovechable en las reacciones químicas, así como su uso como medida de probabilidad y desorden en sistemas.
- Concepto de entropía y su significado en diferentes disciplinas
- Relación de la entropía con la física y la química
- Rol de la entropía en la termodinámica y el segundo principio
- Cálculo y unidades de la entropía en sistemas físicos y químicos
- Entropía y su relación con la energía no aprovechable en reacciones químicas
- La entropía como medida de probabilidad y desorden en sistemas
- Entropía absoluta y la tercera ley de la termodinámica
Concepto de entropía y su significado en diferentes disciplinas
Entropía en física
En el contexto de la física, la entropía se define como una medida de la "desorden" o "caos" de un sistema. Cuanto mayor es la entropía de un sistema, mayor es su nivel de desorden y menor es su nivel de organización. La entropía es una propiedad termodinámica que se utiliza para describir el estado y el comportamiento de los sistemas físicos.
La entropía se relaciona con la probabilidad de los microestados compatibles con el macroestado de equilibrio de un sistema. En términos más simples, se puede pensar en la entropía como una medida de cuántos "estados posibles" hay para un sistema dado. Cuando un sistema tiene muchos microestados posibles, su entropía es alta y su grado de desorden es elevado. Por el contrario, cuando un sistema tiene pocos microestados posibles, la entropía es baja y el grado de orden es mayor.
La entropía también está relacionada con la transformación de la energía en un sistema. En un proceso reversible, la entropía se mantiene constante. Sin embargo, en un proceso irreversible, como la disipación de energía o la generación de calor, la entropía aumenta.
Entropía en química
En química, la entropía juega un papel crucial en la descripción de las reacciones químicas y la energía asociada a ellas. La entropía química se refiere al desorden molecular en un sistema y está relacionada con la dispersión de las partículas y su movimiento.
Durante una reacción química, los enlaces entre átomos se rompen y se forman nuevos enlaces. Esto implica un cambio en la organización molecular y, por lo tanto, en la entropía del sistema. En general, las reacciones químicas tienden a aumentar la entropía debido al aumento en el número de microestados posibles.
La entropía también se utiliza para determinar la parte no aprovechable de la energía en un sistema químico. En una reacción química, parte de la energía liberada se puede aprovechar para realizar trabajo útil, mientras que el resto se disipa como calor. Cuanto mayor sea la entropía de un sistema, menor será la cantidad de energía aprovechable que se puede obtener de él.
Relación de la entropía con la física y la química
La entropía es un concepto clave tanto en la física como en la química, ya que se aplica a una amplia gama de sistemas y procesos en ambos campos. Si bien la forma exacta en que se utiliza y se calcula la entropía puede variar, su significado fundamental de probabilidad y desorden se mantiene constante en ambas disciplinas.
En física, la entropía se utiliza para describir y predecir el comportamiento de sistemas físicos, como gases, líquidos y sólidos. Por ejemplo, la entropía se utiliza para determinar la dirección en la que ocurren los procesos naturales y para calcular la eficiencia de las máquinas térmicas.
En química, la entropía es una herramienta fundamental para analizar las reacciones químicas y predecir la dirección en la que se llevarán a cabo. La entropía se utiliza para calcular cambios de entropía en diferentes etapas de una reacción química y determinar si una reacción es espontánea o no.
La entropía es un concepto fundamental en la física y la química que se utiliza para describir y analizar el comportamiento y la transformación de los sistemas. Su significado y aplicación pueden variar según el contexto, pero su base de probabilidad y desorden es constante en ambas disciplinas.
Rol de la entropía en la termodinámica y el segundo principio
La entropía desempeña un papel crucial en la termodinámica, que es el estudio de las interacciones de la energía y el calor en los sistemas. El segundo principio de la termodinámica establece que la entropía de un sistema cerrado siempre tiende a aumentar o mantenerse constante en el transcurso de un proceso espontáneo.
El segundo principio de la termodinámica se basa en la idea de que los procesos naturales tienden a aumentar la entropía total del sistema y su entorno. Esto significa que, en promedio, los sistemas tienden a volverse más desordenados y a distribuir su energía de manera menos útil a medida que pasa el tiempo.
La entropía también está relacionada con la eficiencia de las máquinas térmicas, como los motores de combustión interna. La eficiencia de una máquina térmica se puede calcular utilizando la diferencia entre la temperatura absoluta del suministro de calor y la temperatura absoluta del sumidero de calor, así como el cambio de entropía en el proceso.
La entropía desempeña un papel fundamental en la termodinámica y está estrechamente relacionada con el segundo principio de la misma. La tendencia natural de los sistemas a aumentar su entropía y disminuir su nivel de organización es una característica clave de los procesos termodinámicos.
Cálculo y unidades de la entropía en sistemas físicos y químicos
La entropía se expresa en unidades de energía dividida por temperatura. En el Sistema Internacional de Unidades (SI), la unidad de entropía es el julio por kelvin (J/K).
En sistemas físicos, la entropía se calcula utilizando la relación entre el cambio de calor (Q) y la temperatura absoluta (T) del sistema. La fórmula para calcular la entropía en un proceso isotérmico es:
S = Q / T
Donde S es la entropía en julios por kelvin (J/K), Q es el cambio de calor en julios (J) y T es la temperatura absoluta en kelvin (K).
En sistemas químicos, la entropía se calcula utilizando la fórmula de cambio de entropía para una reacción química. La fórmula general para calcular el cambio de entropía (ΔS) en una reacción química es:
ΔS = ΣnSf - ΣnSi
Donde ΔS es el cambio de entropía en julios por kelvin (J/K), ΣnSf es la suma de los productos de los coeficientes estequiométricos de los productos (n) y las entropías molares de los productos (Sf), y ΣnSi es la suma de los productos de los coeficientes estequiométricos de los reactivos (n) y las entropías molares de los reactivos (Si).
Ejemplo de cálculo de entropía en una reacción química
Veamos un ejemplo de cómo calcular el cambio de entropía en una reacción química. Consideremos la reacción de la combustión completa del metano (CH4) en presencia de oxígeno (O2) para formar dióxido de carbono (CO2) y agua (H2O):
CH4 + 2O2 -> CO2 + 2H2O
Para calcular el cambio de entropía en esta reacción, necesitamos conocer las entropías molares estándar de los reactivos y los productos.
Supongamos que las entropías molares estándar del metano, el dióxido de carbono y el agua son 186.2 J/(mol·K), 213.7 J/(mol·K) y 188.7 J/(mol·K), respectivamente.
Calculamos primero el cambio de entropía para los productos:
ΔSf = (1 mol CO2)(213.7 J/(mol·K)) + (2 mol H2O)(188.7 J/(mol·K)) = 590.1 J/K
Luego, calculamos el cambio de entropía para los reactivos:
ΔSi = (1 mol CH4)(186.2 J/(mol·K)) + (2 mol O2)(0 J/(mol·K)) = 186.2 J/K
Finalmente, calculamos el cambio de entropía para la reacción:
ΔS = ΔSf - ΔSi = 590.1 J/K - 186.2 J/K = 403.9 J/K
Por lo tanto, el cambio de entropía para la combustión del metano es de 403.9 J/K.
Entropía y su relación con la energía no aprovechable en reacciones químicas
La entropía está relacionada con la energía no aprovechable en las reacciones químicas. Durante una reacción química, parte de la energía liberada se puede utilizar para realizar trabajo útil, como mover un objeto o generar electricidad. Sin embargo, también hay una parte de la energía que se disipa como calor y no se puede aprovechar para realizar trabajo.
La entropía se utiliza para medir la parte no aprovechable de la energía en un sistema químico. Cuanto mayor sea la entropía de un sistema, menor será la cantidad de energía aprovechable que se puede obtener de él.
Por ejemplo, en la reacción de combustión del metano que mencionamos anteriormente, parte de la energía liberada se puede utilizar para realizar trabajo útil, como calentar una habitación. Sin embargo, también hay una parte de la energía que se disipa como calor y no se puede aprovechar para realizar trabajo.
La entropía se relaciona con esta energía no aprovechable porque medida la dispersión y el desorden molecular en el sistema. A medida que aumenta la entropía de un sistema, también lo hace la cantidad de energía no aprovechable.
La entropía se relaciona con la energía no aprovechable en las reacciones químicas. Cuanto mayor sea la entropía de un sistema, menor será la cantidad de energía aprovechable que se puede obtener de él.
La entropía como medida de probabilidad y desorden en sistemas
La entropía se utiliza como medida de probabilidad y desorden en sistemas físicos y químicos. Cuanto mayor sea la entropía de un sistema, mayor será su grado de desorden y menor será su nivel de organización.
La entropía también está relacionada con la incertidumbre y la probabilidad de los microestados posibles de un sistema. Cuanto mayor sea el número de microestados posibles, mayor será la entropía y menor será la probabilidad de estar en un estado particular.
En términos más simples, la entropía se puede pensar como una medida de cuántos "estados posibles" hay para un sistema dado. Cuando un sistema tiene muchos microestados posibles, su entropía es alta y su grado de desorden es elevado. Por el contrario, cuando un sistema tiene pocos microestados posibles, la entropía es baja y el grado de orden es mayor.
La entropía también está relacionada con la transformación de la energía en un sistema. En un proceso reversible, la entropía se mantiene constante. Sin embargo, en un proceso irreversible, como la disipación de energía o la generación de calor, la entropía aumenta.
La entropía se utiliza como medida de probabilidad y desorden en sistemas físicos y químicos. Cuanto mayor sea la entropía de un sistema, mayor será su grado de desorden y menor será su nivel de organización.
Entropía absoluta y la tercera ley de la termodinámica
La entropía absoluta, representada por S en lugar de ΔS, se define según la tercera ley de la termodinámica. Esta ley establece que la entropía de un sistema en el cero absoluto (0 Kelvin) es igual a cero.
La tercera ley de la termodinámica se basa en la observación de que a medida que la temperatura de un sistema se acerca al cero absoluto, el movimiento de las partículas se reduce hasta que se detiene por completo. En este estado de mínimo movimiento, el sistema se encuentra en su estado de menor energía y, por lo tanto, su entropía es cero.
La entropía absoluta se utiliza como referencia para calcular el cambio de entropía en un proceso. El cambio de entropía de un sistema se calcula tomando la diferencia entre las entropías absolutas de los estados inicial y final del sistema.
Es importante destacar que la entropía absoluta solo se puede determinar hasta un factor aditivo constante. Esto significa que solo se puede calcular el cambio de entropía en un proceso, no la entropía absoluta de un sistema.
La entropía absoluta también se utiliza para establecer escalas de entropía relativa, como la entropía estándar, que se utiliza en la termodinámica para cuantificar el grado de espontaneidad de una reacción química.
La entropía absoluta, definida según la tercera ley de la termodinámica, es igual a cero en el cero absoluto. La entropía absoluta se utiliza como referencia para calcular el cambio de entropía en un proceso y para establecer escalas de entropía relativa.
- Qué es la radiación y cómo afecta nuestra vida diaria
- Cómo se calcula la resistencia total en circuitos en paralelo
- Segunda Condición de Equilibrio en Física: Ejemplos
- Segunda Ley de la Termodinámica: Fórmulas y Ejemplos
- Cómo resolver circuitos en serie con resistencias
- Ejercicios resueltos sobre la segunda ley de Newton
